在精准医学的语境下,越来越多的证据表明:大量致病线索潜伏在基因组“非编码区”。但临床与基础研究真正需要回答的,是两个更“落地”的问题——某个非编码突变会让下游基因上调还是下调?以及这种影响在不同组织或细胞类型中是否一致、强弱如何?近日,围绕这两个关键点,在线直播-性爱直播-古装做爱 林关宁教授团队提出了EMO研究框架并发表于Nature Computational Science(IF=18.3)。这项工作试图回答临床与科研界长期的两大难题:一个非编码突变,会让目标基因“上调还是下调”?影响到底有多强? 更关键的是,答案会随组织、细胞类型甚至疾病状态而改变。EMO 的设计初衷,就是把这种“语境决定效应”的规律写进模型里,让结论可迁移、可解释,也更接近真实生物学。

为什么这很难?传统深度学习方法多以DNA 序列为唯一输入,得到的是面向“平均个体”的静态结论:同一变异在肝脏与脑内可能方向相反、在炎症刺激前后强弱迥异,但旧模型很难识别。EMO在输入端把DNA 序列与 ATAC-seq 染色质可及性逐碱基对齐后联合建模;在结构端采用“双分支+分而治之”思路:一支聚焦变异点附近的局部影响,另一支覆盖从突变位点到靶基因 TSS 最远 ±1 Mb 的长距离顺式调控区间;在任务端把方向判别(上/下调)与强度回归(eQTL 斜率)拆分训练,并用稀疏注意力与尺度感知池化,既压住了长序列计算量,又把增强子、TF 结合位点等功能区域“高亮”出来。这套机制既像“广角镜头”,也像“放大镜”,兼顾远近两端的调控证据。
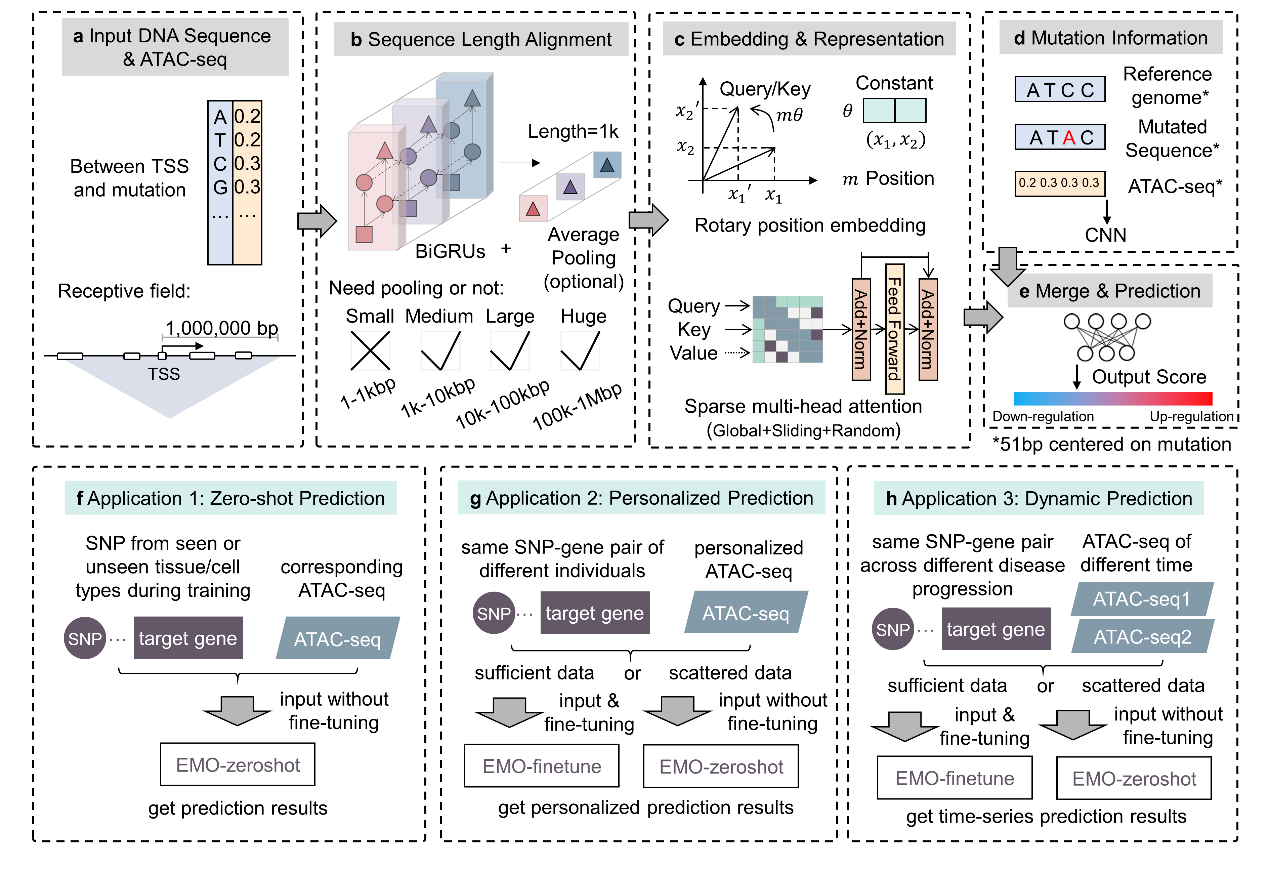
图1. EMO模型架构及应用场景
训练素材同样强调“语境”。团队以 GTEx v8 多组织 eQTL 为标签,配对 EpiMap 的组织/细胞类型特异 ATAC-seq 数据,序列与表观信号逐碱基对齐后输入模型,大幅增强了“不同组织/细胞里同一突变可能不同”的可学习性。这样做的结果,是在看不见的组织也能基于其 ATAC-seq 进行“零样本”推断;而在小样本目标组织,只需少量微调即可获得稳定输出,避免端到端小样本训练常见的“全部判上调”的坍塌。
从大家关心的“到底好用吗”开始看数据。首先,在多组织独立测试中,带跨组织预训练的 EMO-zeroshot/finetune 相比端到端与多款代表性方法(如 Enformer、Basenji2、Expecto)整体表现更稳,尤其在上/下调方向判别上优势明显,说明模型确实学到了“序列—染色质—表达”的通用表征而不是死记硬背。
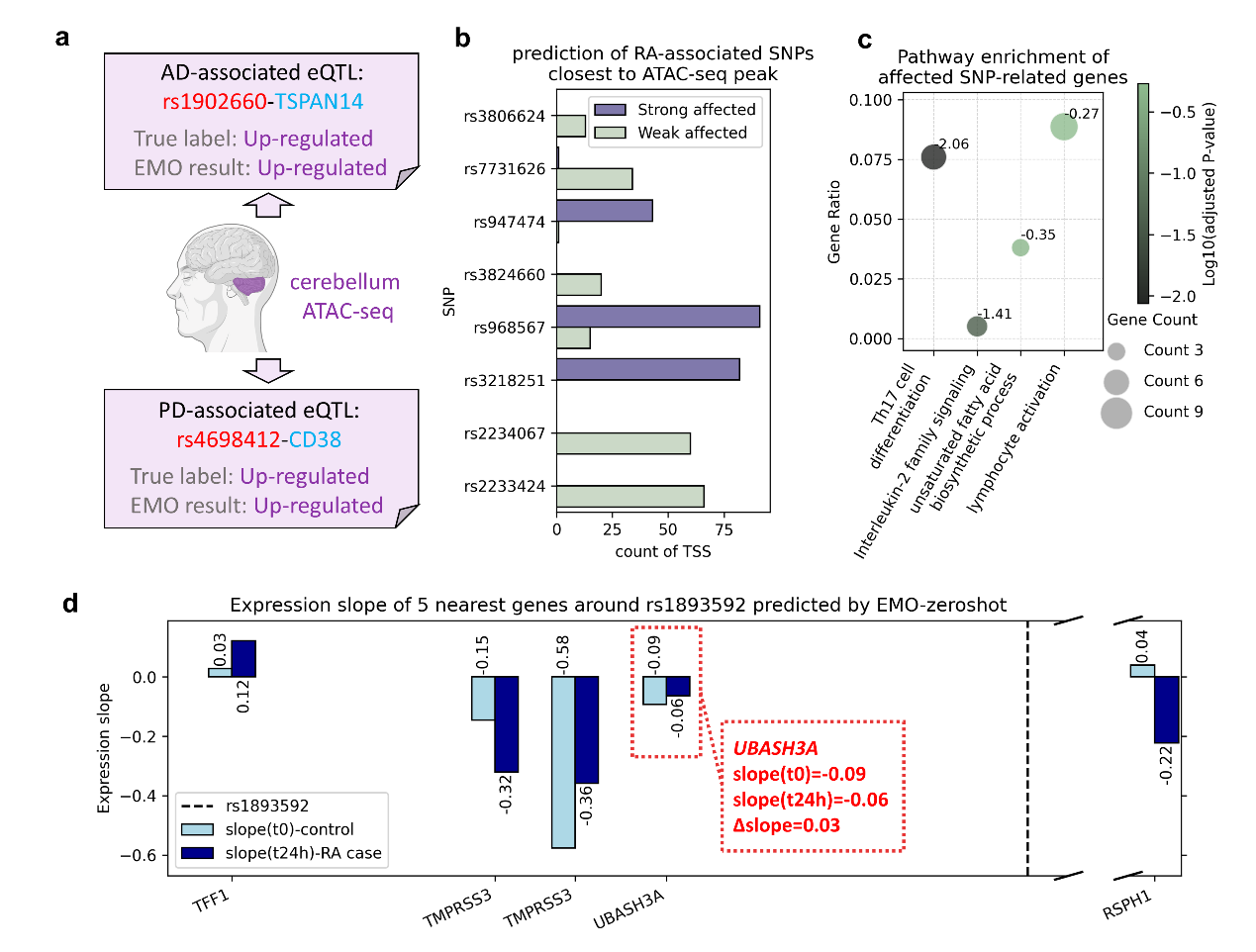
图2 EMO在疾病关联SNP分析中展示出了Zero-Shot预测能力与疾病动态预测能力
其次,把模型迁移到脑组织(MetaBrain 的海马体与脊髓)时,在样本有限的真实条件下,微调后的 EMO 在 10–100 kb 中距区间把 AUC 分别提升 0.164 与 0.079,并有效避免预测坍塌,这对难获取样本的组织尤其关键。
第三,EMO 进一步下沉到单细胞层面。在 OneK1K 队列的六类免疫细胞中,EMO 的方向判别 AUC 达到 0.861–0.948;在与多发性硬化相关的 rs1465697 案例里,模型能在不同 T 细胞亚群里给出细胞类型特异的强度估计(斜率),把“到底哪类免疫细胞更敏感”的问题落到量化上。对精准分型与靶点优选,这类“指向细胞类型”的证据非常实用。
更贴近应用的,是零样本推断。只要目标组织有可用 ATAC-seq,哪怕没有在该组织训练,EMO 也能直接判别方向。以小脑为例,团队对两则神经精神疾病相关 eQTL 做了验证:rs4698412–CD38(帕金森病)与 rs1902660–TSPAN14(阿尔茨海默病),模型分别给出 93.7% 与 69% 的上调概率,方向均与文献一致。这意味着在低样本、低门槛的情形下,仍可得到可信的机制线索。
为验证区分力的“下限”,研究者还构造了一个“近似非因果”的负控集合(PPC < 0.001 且 |slope| 小),结果显示 EMO 的回归输出能显著区分强效上/下调与弱效/无效变异;更有意思的是,在这些“非因果”样本里,模型还能“捞出”若干与疾病风险相关的 GWAS 位点,提示它有望补回统计细粒度分析的漏检。
在免疫疾病的真实场景中,EMO 还能把疾病过程前后的调控差异“量出来”。团队用 CD4⁺ T 细胞“未刺激 vs 24h 刺激”的 ATAC-seq 表示类风湿关节炎(RA)的状态变化,围绕 RA 相关 GWAS 位点,计算两状态下的斜率差值(Δslope),据此分组并做通路富集,结果显著聚焦在Th17 分化与IL-2 家族等核心免疫通路。这条“位点→强弱差异→通路”的链路,恰是临床研究者最需要的可行动证据。
故事的“另一半”来自 Methven。今年1月,团队在Advanced Science 发表了Methven工具:它回答的是“非编码突变如何改变 DNA 甲基化”,而且是单细胞分辨率。Methven同样整合 DNA 序列与单细胞 ATAC-seq,以 DNABert2 预训练表征 + BiGRU 为核心,在 ±100 kb 区间内建模 SNP-CpG 作用,既做方向判别也做强度回归。系统比较显示,它在长短距离两档均优于既有方法(如 CpGenie、Enformer),对单核细胞等外部数据也有不错的外推;在 RA 应用里,Methven 能定位到与病程相关的 CpG 与通路,提供表观层的因果线索。

把两项工作串起来,就是一个更完整、也更贴近临床的问题链:
Methven 先回答“表观层怎么变”(SNP→CpG 甲基化的方向与强度,且可到单细胞);EMO 再回答“转录层怎么变”(SNP→目标基因表达的上/下调及幅度,可横跨组织到单细胞)。当两者在同一批候选位点上“会师”,研究者就能筛出表观与转录双阳性的高可信组合,优先进入湿实验,缩短“GWAS 精细定位→机制验证→靶点线索”的路径。对临床医生而言,这意味着更清晰的致病细胞类型和关键通路,对药物研发团队而言,这意味着优先级更高、风险更低的验证名单。
这套方法为何容易“落地”?一是输入友好:很多中心都在积累 ATAC-seq 或相近的开放染色质数据,EMO/Methven 都能直接吃进来;二是迁移省样本:EMO 在目标组织小样本上即可稳定微调,甚至在零样本场景也能做方向判别;三是解释做得出手:注意力权重把潜在调控元件高亮,通路富集把生物学语义连起来,科研与临床团队更容易共识化沟通。
当然,团队也坦陈边界:当某些组织/状态下 ATAC-seq 信噪较弱时,对细微强弱差异的分辨仍有提升空间;而长距离建模虽已靠稀疏注意力优化,但在大队列和更高通量的应用上,还需要工程层面的进一步加速与裁剪。下一步,研究将引入更多层次的表观数据(如组蛋白修饰)、探索多任务学习与网络先验结合,并在更广谱疾病人群中做前瞻性验证,把“位点—表观—转录—通路—表型”的证据链压得更实。
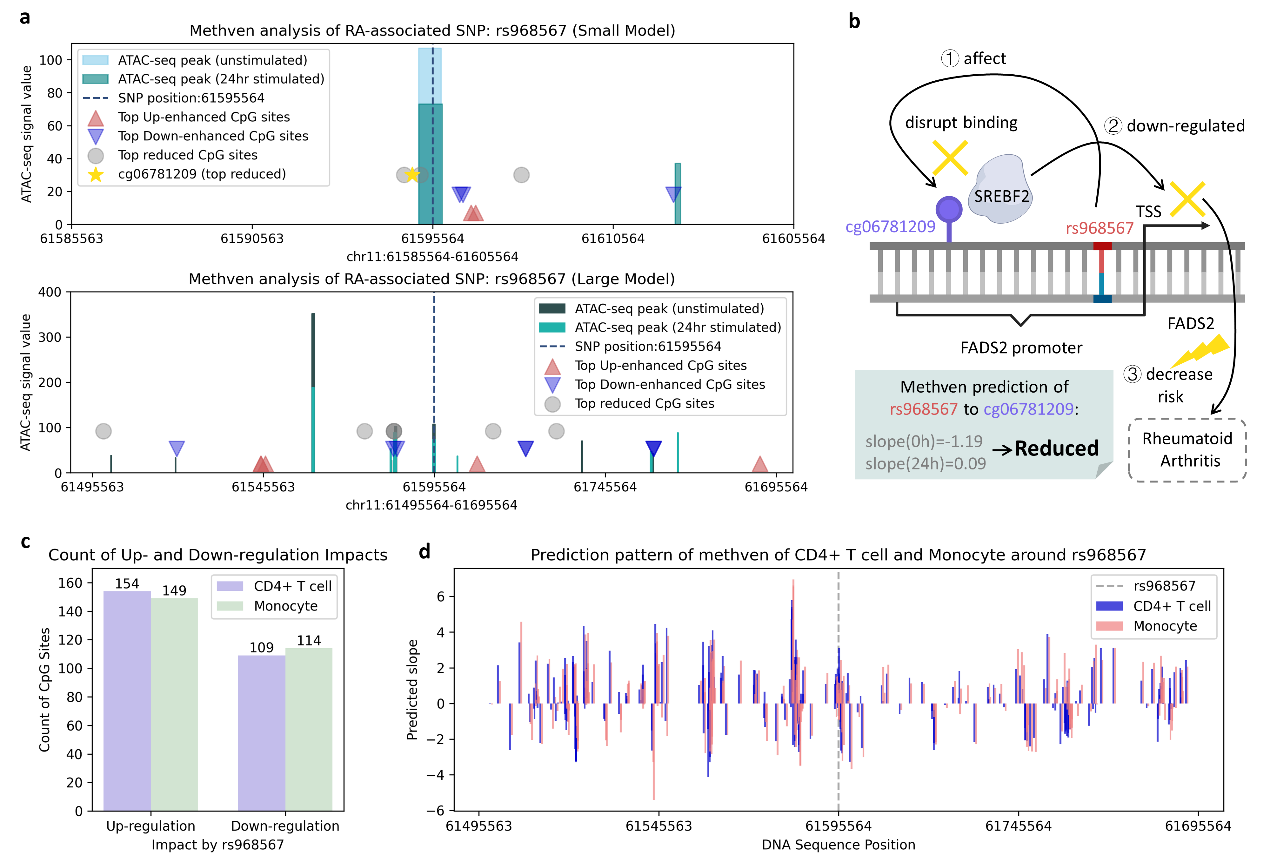
图3 Methven对跨细胞类型的调控模式分析及案例研究
研究团队想传递的核心信息是:非编码突变不再只能被“静态注释”。借助 EMO × Methven,研究者可以在真实语境里定量回答“它会把基因往上推还是往下拉?”“改变有多强?”“发生在谁的细胞里、哪条通路上?”——这正是连接基础研究、临床转化与药物研发的共同语言。期待与更多学术与临床团队合作,把这门“读懂非编码”的新能力,用在真正影响患者结局的问题上。
作者信息:本系列研究由刘喆博士(完成于在线直播-性爱直播-古装做爱 ,现为华东理工大学讲师)担任两篇论文的第一作者,由林关宁教授担任两篇论文的通讯作者(EMO 见 Nature Computational Science 2025;Methven 见 Advanced Science 2025)。
课题组介绍:
在线直播-性爱直播-古装做爱 林关宁课题组(Brain-Multimodal Informatics Lab, BMI, //bmi.zaixianzhibo.net/)长期从事生物信息学辅助精神心理疾病机制解读、脑疾病的多模态生理-病理特征解析与人工智能模型构建,研究聚焦于跨模态特征的整合与建模,包括血液多组学、生理信号及临床电子病历等数据,推动AI在精神疾病早期诊断、预后预测与智能干预中的应用转化。研究成果涵盖精神疾病的分子诊断、临床辅助系统开发、大模型在医学中的应用及智能诊疗平台建设。
论文链接:
EMO: //www.nature.com/articles/s43588-025-00878-7
Methven: //advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202413571